Em uma decepção para pacientes e pesquisadores de Alzheimer, a farmacêutica Eli Lilly disse no final de novembro que um ensaio clínico de solanezumab, um medicamento experimental para tratar a condição neurológica degenerativa, havia fracassado.
A empresa avançou com testes de solanezumab, apesar dos resultados mistos em estudos anteriores. O mais recente teste, envolvendo mais de 2.000 pacientes, descobriu que a droga não reduziu significativamente o declínio cognitivo em pacientes com demência leve da doença de Alzheimer.
O triste refrão é familiar, infelizmente.
Solanezumab é apenas a mais recente vítima em um desfile de décadas de testes de drogas demência decepcionantes. Mas a frustração trazida por esse fracasso em particular pode sinalizar uma mudança na pesquisa de Alzheimer – uma mudança de foco das acumulações da chamada proteína amilóide no cérebro, há muito considerada por muitos no campo como o ponto crucial da patologia de Alzheimer.
Desde a descoberta do Dr. George G. Glenner, em 1984, de que o amilóide é o principal componente das placas que afetam o cérebro afetado pelo mal de Alzheimer, presume-se que a proteína contribui de alguma forma para o distúrbio – que atola o mecanismo celular, tornando os neurônios incapazes. para efetivamente comunicar, para formar novas memórias, para lembrar onde estão as chaves.
Como muitos outros medicamentos fracassados para a doença de Alzheimer sintomática, o solanezumab atua atacando a amilóide no cérebro.
Então, à luz das novas descobertas, finalmente é hora de deixar a teoria amilóide ir? A resposta não está clara.
“A baixa magnitude dos efeitos apoiaria a ideia de que talvez seja hora de partir da amilóide”, diz o neurologista Dr. Richard Isaacson, do Weill Cornell Medical College, que não participou do estudo sobre solanezumabe. “Ainda que o estudo tenha fracassado no geral, houve melhorias na cognição e função em pacientes tratados.”
Ele aponta que talvez a dose testada não tenha sido alta o suficiente ou que a doença dos pacientes estivesse avançada demais para responder. Quando surgem os sintomas da doença de Alzheimer, o cérebro já está salpicado de amilóide. Dois outros estudos em andamento devem confirmar se o solanezumab é mais eficaz em pacientes com risco para o mal de Alzheimer, mas que ainda não desenvolveram sintomas, diz ele.
O Solanezumab, um anticorpo, atua atacando a amilóide que flutua no líquido cefalorraquidiano. Um tipo diferente de medicação experimental, os chamados inibidores de BACE, previne a formação de amilóide, neutralizando uma enzima que corta o amilóide de uma proteína maior. O aducanumab da Biogen, outra droga experimental que está longe em testes clínicos, liga-se e limpa a amilóide que já está presa em placas.
No início deste ano, a FDA concedeu o status de aducanumab fast-track após os resultados de um pequeno estudo inicial sugerirem que ele reduz as placas amilóides e diminui o declínio cognitivo em pessoas com doença em estágio inicial. Essas pessoas tinham depósitos amilóides visíveis com tomografia por emissão de pósitrons. Na reunião de Ensaios Clínicos sobre Doença de Alzheimer e Demência, em San Diego, no início de dezembro, foram apresentados dados de acompanhamento que confirmaram a melhora cognitiva até dois anos de tratamento.
“A boa notícia é que existem vários ensaios em andamento com diferentes drogas anti-amilóides em indivíduos assintomáticos; e que uma droga falida não significa que outra não tenha efeito ”, diz o Dr. James Burke, professor de medicina e psiquiatria do Centro de Pesquisa de Doença de Alzheimer da Duke University. “Estes ensaios também sugerem que a melhor chance para um efeito significativo sobre a cognição é provavelmente o tratamento de pessoas assintomáticas com depósitos de amilóide em imagens”.
No entanto, acrescenta Burke, se esses estudos não mostrarem um benefício clínico significativo, o foco na amilóide provavelmente terminará.
De qualquer forma, Isaacson, da Weill, acha que os pesquisadores deveriam estar buscando outras opções. “Eu nunca fui um crente firme na hipótese amilóide sendo o ser-tudo e no final de tudo quanto à causa da doença de Alzheimer”, diz Isaacson. “Eu acho que é muito mais complicado e provavelmente há muitas estradas que levam à doença.”

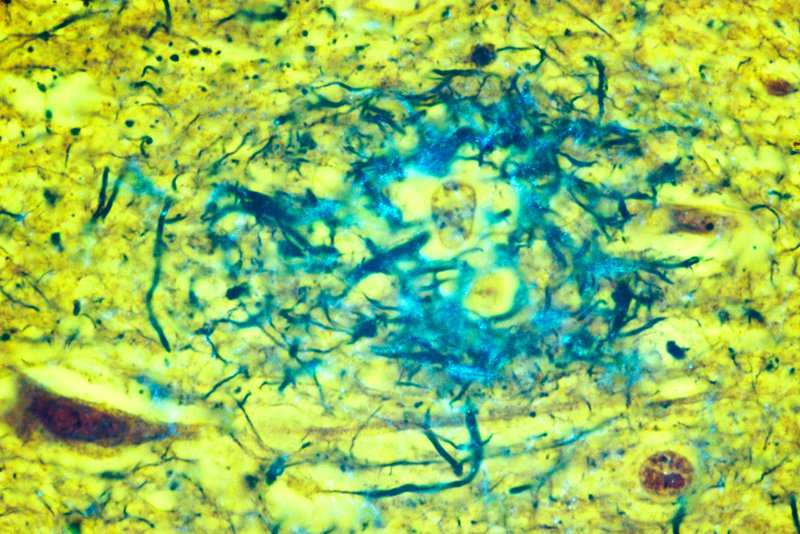
Micrografia de deconvolução fluorescente de células gliais cultivadas expressando proteína tau (em vermelho). Células gliais são células do sistema nervoso que fornecem suporte estrutural e proteção para os neurônios (células nervosas). A acumulação de tau no tecido cerebral está relacionada com um número de doenças neurodegenerativas, incluindo a doença de Parkinson e a doença de Alzheimer.
Roger J. Bick, Kha Dinh / Mya C. Schiess / UT-Houston Fonte de Medicina / Ciência
Uma dessas vias pode ser a de direcionar a proteína tau, que também se acumula em emaranhados dentro do cérebro prejudicado pelo mal de Alzheimer. Outra envolve o tratamento da inflamação que ocorre com a demência, pois o sistema imunológico tenta eliminar a amilóide agrupada. Ainda mais simples são as intervenções dietéticas. Dietas semelhantes às do Mediterrâneo, com alto teor de ácidos graxos ômega-3, mostram-se promissoras na redução do declínio cognitivo.
Como em muitos outros distúrbios, entender completamente a doença de Alzheimer pode acabar por determinar como nossos corpos interagem com os trilhões de micróbios que vivem em nossos intestinos, ou nossa “microbiota”. Pesquisas em animais e humanos sugerem que certas combinações desses organismos podem reverter. o sistema imunológico de maneiras que contribuem para a demência. Um estudo publicado em julho na Scientific Reports descobriu que um longo período de tratamento antibiótico para alterar a flora intestinal em camundongos propensos à demência reduziu o número e o tamanho das placas amilóides no cérebro.
Quer se trate de antibióticos, probióticos ou vacinas, a lista de potenciais tratamentos de Alzheimer está sendo considerada continua.
“O resultado é que precisamos fazer mais chutes a gol”, diz Isaacson. “A próxima fronteira é reconhecer que provavelmente não existe uma abordagem única e que usar terapias direcionadas com base na biologia e na genética de uma pessoa trará o maior benefício. O futuro da terapêutica de Alzheimer está na medicina de precisão ”.
Bret Stetka é escritor baseado em Nova York e diretor editorial do Medscape. Seu trabalho apareceu na Wired , Scientific American e no site The Atlantic.com. Ele se formou na Universidade de Virginia School of Medicine em 2005. Ele também está no Twitter: @BretStetka.
fonte: www.npr.org